Osteopatia e Glaucoma: un trattamento sconosciuto
a cura di: Saverio Colonna - Dir. San. Spine Center, Dir.Gen. Scuola di Osteopatia OSCE
L'osteopatia rimane in gran parte sconosciuta nel mondo dell'oftalmologia, tuttavia sta diventando più comune la sua applicazione nella prevenzione e terapia dell’apparato visivo in patologie quali: glaucoma, miopia, ipermetropia, astigmatismo, strabismo, ecc.
I nostri occhi giocano un ruolo importante nel modo in cui i nostri corpi interagiscono con l'ambiente esterno. La nostra postura si adatterà per mantenere i nostri occhi orizzontali. I nostri occhi sono strettamente collegati con le nostre orecchie per rivolgere in modo riflessivo lo sguardo verso i suoni che potrebbero richiedere la nostra attenzione immediata. Considerato quale ruolo importante svolgono i nostri occhi nella nostra postura e funzione generale, credo che siano strutture comunemente trascurate e non adeguatamente trattate. Come osteopati, possiamo fare molto di più nella collaborazione con l’optometrista per le prescrizioni sugli occhiali o lenti a contatto. Pur se i trattamenti osteopatici rivolti all’apparato visivo, alle strutture craniche e ai sistemi vascolari possono aiutare nella terapia di diverse patologie visive quale (miopia, ipermetropia, astigmatismo, cataratta, ecc.), in questo articolo prenderemo in considerazione solo una patologia abbastanza frequente quale il glaucoma.
Richiami di anatomia e fisiologia
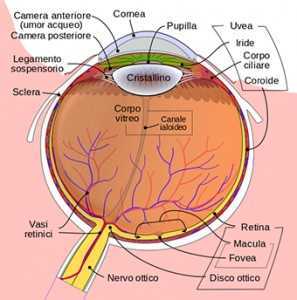
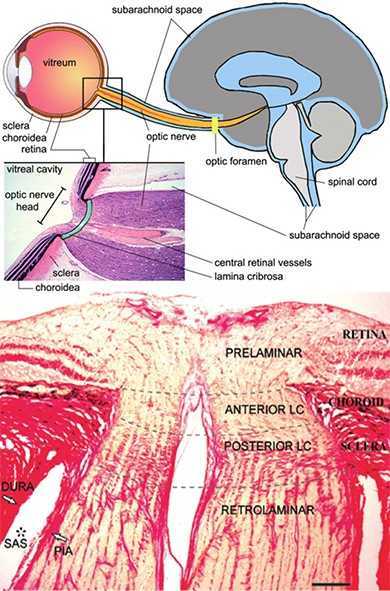
l globo oculare prevede una copertura anteriore, protetta dalle palpebre, che è la cornea (fig. 1). La cornea è una membrana trasparente convessa anteriormente che costituisce la porzione anteriore della tonaca fibrosa e del bulbo oculare e rappresenta la lente più potente dell'apparato visivo. Assieme al cristallino forma il diottro oculare. Ha uno spessore "normale" al centro di poco superiore a mezzo millimetro e, vista anteriormente ha una forma leggermente ellittica con il diametro maggiore orizzontale lungo 11,7 mm contro i 10,6 mm del diametro minore. Nel complesso forma il 7% della superficie dell'occhio esterno. Tra la cornea e il cristallino sono presenti due camere che contengono l’umore acqueo, l’iride divide la camera anteriore da quella posteriore.
Umore acqueo
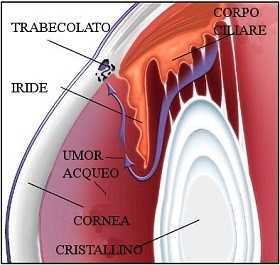
L'Umore acqueo L'umore acqueo è un liquido salino simile al plasma con una minore quantità di proteine che si trova tra la cornea e il cristallino, contribuisce a dare volume al bulbo oculare e nutrire le strutture avascolari quali la cornea e il cristallino. L'umore acqueo viene prodotto da una parte del corpo ciliare, struttura che si trova dietro l’iride (fig. 2); questo liquido circola nella camera posteriore e passando attraverso il foro della pupilla arriva nella camera anteriore dell'occhio. Tale liquido viene riassorbito da una zona anatomica chiamata trabecolato sclerocorneale, che si trova nell'angolo della camera anteriore dell'occhio, dove attraverso i canali di Schlemm viene drenato nelle vene dell’episclera collocate al passaggio della cornea e la sclera.
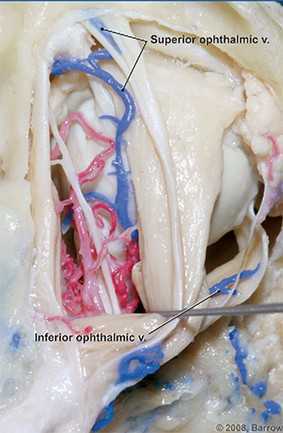
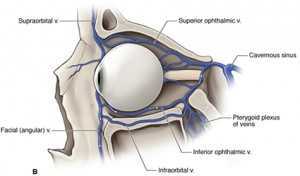
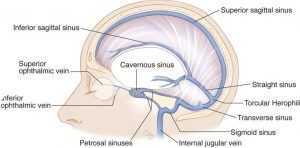
Dai vasi dell’episclera l’umore acqueo viene drenato dalla vena oftalmica superiore ed inferiore (fig. 3). La vena oftalmica superiore, di calibro considerevole, è la più importante. Il suo decorso, nella parte superiore della cavità orbitaria corrisponde presso a poco a quello dell’arteria oftalmica.
Inizia in corrispondenza dell’angolo interno dell’occhio con due radici, dalla vena sovraorbitale e dalla vena nasofrontale attraverso la quale è anastomizzata con la vena angolare, tronco iniziale della vena faciale anteriore.
Si porta in dietro percorrendo l’angolo tra le pareti superiore e mediale dell’orbita, fuoriesce attraverso la fessura orbitaria superiore e raggiunge l’estremo anteriore del seno cavernoso (fig. 4). Riceve le vene etmoidali anteriore e posteriore, la vena lacrimale, vene muscolari e le vene vorticose superiori provenienti dal bulbo oculare. Non possiede valvole.
La vena oftalmica inferiore, più piccola, origina da venule del sacco lacrimale e della palpebra inferiore; decorre nella parete inferiore dell’orbita e raggiunge, anch’essa attraverso la fessura orbitaria superiore, il seno cavernoso.
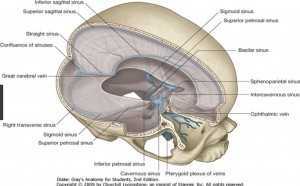
È anastomizzata con la vena oftalmica superiore e riceve vene muscolari e le vene vorticose inferiori. Non ha valvole. La vena centrale della retina sbocca anch’essa nel seno cavernoso, talvolta nella vena oftalmica superiore. Il seno cavernoso, collocato bilateralmente a livello corpo dello sfenoide, è una struttura che entra a fare parte dei seni venosi durali (fig. 5) che scaricano nelle vene giugulari interna (fig. 6).
Glaucoma
In condizioni normali all’interno dell’occhio è presente L’umore acqueo che viene continuamente prodotto e riassorbito. Pertanto, l’occhio si può paragonare a un piccolo serbatoio con un rubinetto e uno scarico sempre aperti. Se quest’ultimo è invece ostruito, è come se si chiudesse parzialmente il tappo del lavandino quando l'acqua scorre, si avrà un aumento di pressione all’interno del serbatoio ovvero una maggiore pressione intraoculare. In condizioni normali, invece, questo ciclo di produzione e riassorbimento continuo consente di mantenere una pressione positiva all'interno dell'occhio entro il limite massimo dei 21 mm Hg. Se la pressione è troppo elevata a lungo andare il bulbo oculare si danneggia a livello del nervo ottico, situato nella zona centrale della retina.
L’aumento della pressione danneggia irreparabilmente i neuroni che trasportano il segnale elettrico; dunque è come se si logorassero. Inizialmente il danno colpisce i fili che trasportano le immagini relative alla periferia del campo visivo a differenza della cataratta che colpisce tutto il campo: chi è malato continua a vedere l’oggetto che fissa, ma non si accorge che l’area visiva periferica (visione laterale) si sta riducendo progressivamente (fig. 7 ).
La visione centrale viene in genere colpita per ultima ed è per questo che una persona affetta da glaucoma, pur avendo degli importanti limiti nello svolgere le abituali attività (non vedere gradini se è persa la porzione inferiore del campo visivo, urtare contro pareti o spigoli, avere difficoltà alla guida, notare parole mancanti durante la lettura), può mantenere una acuità visiva alta, anche i famosi “dieci decimi”.
Da ultimo vengono lesi anche i fili che provengono da quella zona della retina con cui si fissano gli oggetti (macula) e, se il glaucoma non viene trattato con successo, si riduce l’acuità visiva fino alla cecità completa per il danno del fascio di fibre nervose papillo-maculari.
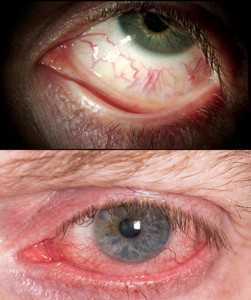
In tutti i glaucomi, escluso il glaucoma acuto, la malattia insorge e progredisce a lungo senza che la persona noti alcun disturbo: é per questo che il glaucoma viene definito come “ladro silenzioso della vista”. Nel momento in cui ci si rende conto di avere difficoltà a vedere (difetti del campo visivo) il danno al nervo ottico è già molto avanzato. Nel glaucoma acuto invece i sintomi sono generalmente evidenti: grave dolore oculare e arrossamento (fig. 8), visione ridotta, aloni colorati, cefalea, nausea e vomito. La sintomatologia è così eclatante che pazienti che giungono al pronto soccorso con un attacco di glaucoma acuto possono correre il rischio di diagnosi errata di disturbi neurologici o problemi gastrointestinali.
Incidenza
l glaucoma è una malattia oculare correlata generalmente a una pressione dell’occhio troppo elevata. Secondo l’OMS ne sono affette almeno 55 milioni di persone nel mondo. Il glaucoma è la seconda causa di cecità a livello planetario dopo la cataratta, ma è la prima causa irreversibile [ www.iapb.org/knowledge/what-is-avoidable-blindness/glaucoma] e rappresenta, quindi, una sfida socioeconomica considerevole (Quigley 1996; Rojas et al 2006). Il glaucoma colpisce circa 70 milioni di persone in tutto il mondo. Secondo alcune stime il glaucoma colpisce il 3,54% delle persone di età compresa tra i 40 e gli 80 anni (Tham et al 2014). in Italia si stima che colpisca circa un milione di persone, ma la metà di esse non ne sarebbero a conoscenza perché non effettuano visite oculistiche periodiche complete. Poiché la perdita della vista causata dal glaucoma è irreversibile, le persone in età avanzata, generalmente colpisce dopo i 40 anni, dovrebbero sottoporsi periodicamente ad un esame oculistico come parte della loro cura di routine. La disabilità visiva provocata dal glaucoma (compresa l’ipovisione) si può prevenire purché la malattia sia diagnosticata e curata tempestivamente.
Classificazione
In base all’eziopatogenesi si possono riconoscere 4 tipi di glaucoma:
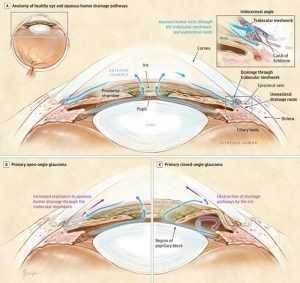
Glaucoma cronico ad angolo aperto (POAG- Primary Open Angle Glaucoma) (fig. 9): è la forma più frequente di glaucoma (circa l’80% dei casi). Si verifica in seguito a un ostacolo che incontra l’umor acqueo nel defluire in particolare attraverso il trabecolato sclerocorneale. Si sviluppa lentamente e in genere non dà sintomi, per cui ci si può rendere conto di essere
Glaucoma acuto ad angolo chiuso (PCAG- Primary Closed Angle Glaucoma) (fig. 9): l’iride può chiudere improvvisamente lo “scarico” (occlusione dell’angolo irido-corneale), causando un rapido aumento della pressione intraoculare nel caso della forma detta ad “angolo stretto” (che colpisce circa il 10% dei glaucomatosi, nel 70% dei casi di sesso femminile). Quest’improvviso incremento pressorio, chiamato attacco acuto di glaucoma, è molto grave: se non curato tempestivamente può portare a cecità in breve tempo. Infatti, è come se si chiudesse di colpo il tubo di scarico di un serbatoio, bloccandone improvvisamente il deflusso. I sintomi principali sono l’offuscamento della vista, la comparsa di aloni anomali attorno alle luci, dolore oculare violento, nausea e vomito. I fattori che predispongono al glaucoma sono, tra l’altro, la riduzione della profondità della camera anteriore (ridotto spazio compreso tra cornea e iride), che si può avere nel caso di ipermetropia elevata, ma anche la cataratta totale (detta “matura intumescente”: il cristallino perde completamente la sua trasparenza ed elasticità fino a sembrare un piccolo sasso bianco).
Glaucoma congenito: in questa forma della patologia oculare il sistema di drenaggio è “cattivo” sin dalla nascita. Per questo motivo si verifica un aumento di pressione intraoculare. Il bambino presenta fastidio alla luce (fotofobia) e lacrimazione eccessiva. L’aumento pressorio può causare un aumento delle dimensioni dell’occhio (nei piccoli le pareti oculari sono meno resistenti) e la cornea può divenire opaca. Ogni sintomo sospetto deve indurre i genitori ad andare dall’oculista per effettuare una visita di controllo. Questo tipo di glaucoma è però raro: colpisce un neonato ogni diecimila.
Glaucoma secondario: in questa forma delle patologia l’ostacolo al deflusso è un effetto secondario di alcune malattie (fra cui il diabete e le trombosi retiniche), dell’uso di alcuni farmaci, passando per emorragie, tumori e stati infiammatori.
Il glaucoma ad angolo primario (PCAG) spesso denominato anche glaucoma angolo acuto o chiuso è più comune in Asia, mentre il glaucoma ad angolo aperto presenta una distribuzione abbastanza uniformemente in tutto il mondo. Negli Stati Uniti, in Europa e in Australia, il 75-95% del glaucoma nei caucasici è il POAG (Quigley 1996; Congdon 1992) mentre il PCAG rappresenta il 70-90% del glaucoma in Cina e in India (Lim 1978; Congdon 1992; Jacob et al 1998). I bianchi soffrono più frequentemente dal POAG. L'aumento della pressione intraoculare (PIO) causato dall'ostruzione del deflusso dell'umore acqueo è uno dei più importanti ma non l'unico fattore di rischio per lo sviluppo del glaucoma (Lee et al. 2015). Il glaucoma ad angolo aperto, il tipo più comune, spesso rimane inosservato dal paziente per un lungo periodo poiché la pressione oculare aumenta lentamente fino a 20 - 30 mmHg (a volte più alta). Per molto tempo la PIO elevata è stata considerata la causa principale dello sviluppo del glaucoma. Oggi è noto che l'aumento della PIO è solo uno dei molti altri fattori di rischio. Ciononostante, una PIO elevata continua a essere considerata una delle principali cause dello sviluppo del danno glaucomatoso. La PIO normale è compresa tra 10,5 e 18 mmHg ( Quigley et al 1996). Poiché il rischio di un'ulteriore progressione della malattia si riduce di circa il 10% per ogni 1 mmHg per mezzo del quale la pressione intraoculare si abbassa, è fondamentale indagare il livello esatto della PIO al fine di prevenire un ulteriore sviluppo del glaucoma (Quigley 1996).
Diagnosi
L’unico modo per effettuare una diagnosi precoce di glaucoma è sottoporsi a una visita oculistica completa. Nel corso della visita i parametri che devono essere controllati sono essenzialmente:
- la pressione dell’occhio (pressione intraoculare). Con il tonometro può essere valutata la pressione all’interno del bulbo oculare in modo da individuare tempestivamente un eventuale aumento;
- la gonioscopia consente l’esplorazione dell’angolo di scarico dell’umore acqueo (angolo irido-corneale) permettendo la suddivisione del glaucoma in angolo aperto e angolo chiuso. Dopo aver anestetizzato l’occhio con un collirio anestetico, al paziente viene applicata una speciale lente a contatto contenente uno specchio che permette all’oculista di osservare se l’angolo di drenaggio sia aperto o chiuso.
- l’aspetto del nervo ottico. Con l’oftalmoscopio il nervo ottico può essere osservato direttamente dallo specialista: nel caso del glaucoma si evidenzia un aumento della cosiddetta escavazione papillare;
- il campo visivo (esame: perimetria computerizzata). È un metodo d’indagine con cui si misura la sensibilità delle diverse zone della retina. Permette d’identificare precocemente i danni e di valutare l’efficacia della terapia molto meglio che con i precedenti metodi di perimetria manuale.
- valutazione del disco ottico (effettuata anche con nuovi metodi).
Grazie allo sviluppo tecnologico sono stati introdotti nella pratica clinica nuovi metodi di valutazione del disco ottico, come il CSLO (Confocal laser ophthalmoscopy ossia oftalmoscopia laser confocale), l’SLP (Scanning laser polarimetry ossia la polarimetria a scansione laser) e l’OTC (Optical Coherence Tomography ovvero la tomografia a coerenza ottica). Si tratta di esami strumentali semplici da effettuare (non invasivi) che consentono lo studio dettagliato della papilla ottica e, soprattutto, la misurazione dello spessore delle fibre nervose attorno ad essa, il cui assottigliamento è dovuto alla perdita di cellule retiniche (in particolare di quelle dette ganglionari e dei loro assoni). Ovviamente le informazioni ottenute da questi strumenti d’imaging dovrebbero essere considerate complementari alle altre valutazioni cliniche. La diagnosi di glaucoma, infatti, non può essere esclusivamente basata sull’uso di queste tecniche. Inoltre è stato ipotizzato persino che si possa verificare una neurodegenerazione neuronale più ampia che coinvolge il sistema nervoso centrale (Frezzotti et al. 2016 ).
Terapia
Nel trattamento del glaucoma cronico con colliri è ancora la terapia più comune e mira a abbassando la PIO. Oggi ci sono diverse classi di farmaci che da un lato riducono la produzione di umor acqueo e dall'altro aumentano il deflusso dell'umore acqueo nel reticolo trabecolare. Nel caso in cui il collirio non sia tollerato dal paziente o l'effetto sull'elevata pressione intraoculare non sia soddisfacente, rimane solo il trattamento chirurgico.
Osteopatia e glaucoma
Nel 1988, William Garner Sutherland, dichiarò: "Nel caso del glaucoma, si può pensare che l'accumulo di liquidi è indice di una condizione della parete membranosa intracranica del seno cavernoso o nelle pareti del seno petroso, dovuta ad una restrizione membranosa che colpisce il ritorno venoso. "( Sutherland 1997). Questa teoria acquista una maggiore credibilità alla luce dei risultati di recenti articoli (Frezzotti et al. 2016; Giorgio et al 2018; ) che riportano nei casi di glaucoma, sia con PIO aumentata che non (Killer e Pircher 2018), una parallela degenerazione del SNC valutata con la RMN .
Un sito anatomico cruciale per il danno glaucomatoso non strettamente collegato alla PIO, potrebbe essere la lamina cribrosa (Quigley et al. 1983; Stowell et al. 2017) (da non confodere con la lamina cribrosa dell’etmoide) (fig. 10). Qui gli assoni non mielinizzati si incrociano dal sito intraoculare a quello retro laminare attraverso una struttura collagenica simile a setacci, in cui gli assoni si trovano nello spazio subaracnoideo, che è riempito con liquido cerebrospinale. La lamina cribrosa e gli assoni del nervo ottico si trovano quindi tra due zone di pressione, pressione intraoculare (IOP) e pressione intracranica (ICP). La differenza tra queste due pressioni è espresso come pressione translaminare (IOP - ICP) (Jonas et al. 2016).
La pressione del liquido cerebrospinale, come potenziale contributo al glaucoma (Morgan et al. 1995; Jonas et al. 2016) , è stata presa in considerazione per la prima volta da un oculista russo K.I. Noishevsky nel 1908, studiando questo sistema in un modello canino, ha trovato la sua rinascita negli anni '70 (Yablonski et al. 1979). Per una descrizione più accurata, deve essere considerata anche la pressione intraorbitale, poiché influenza la pressione nello spazio subaracnoideo del nervo ottico che viene indicato come pressione intracranica ( Morgan 1995). Poiché le misurazioni della pressione intraorbitale, tuttavia, sono invasive, non vengono applicate in un contesto clinico. Va menzionato che non tutti gli Autori concordano sull’influenza della pressione intracranica nella formazione del glaucoma con PIO normale (Pircher et al. 2017; Linden et al. 2017).
Il sangue non è l'unico fluido che è importante per un nervo ottico sano. A differenza di altri nervi cranici, il nervo ottico è circondato completamente dal liquido cefalo rachidiano (LCR) e quindi esposto sia alla pressione che al contenuto di questo liquido. Le funzioni del LCR comprendono la protezione contro i danni meccanici al cervello e al nervo ottico, nutrizione dei neuroni, degli assoni e delle cellule gliali e rimozione dei detriti biologici (Davison 1967) . Il ridotto turnover del LCR con livelli protratti di ABeta e Tauproteina elevati è stato suggerito come uno dei fattori di rischio per la malattia di Alzheimer (Hardy e Selkoe 2002; Tarasoff-Conway et al. 2015). Una diminuzione della dinamica del LCR può causare un aumento concentrazioni di tali proteine tossiche (Chiu et al. 2012). Al fine di mantenere il microambiente omeostatico per il tessuto neurale, il LCR viene riciclato fino a 5 volte al giorno (Davison 1967). La stagnazione del LCR sono considerate parte della fisiopatologia delle malattie neurodegenerative come la malattia di Alzheimer (Serot et al. 2012). Esiste infatti una sovrapposizione di pazienti tra Alzheimer e il glaucoma con fisiologica PIO (Tsolaki et al. 2011; Lai et al. 2017); questo tipo di glaucoma potrebbe infatti essere la prima manifestazione della malattia di Alzheimer all'interno del cul de sac come lo spazio subaracnoideo del nervo ottico, compartimento del LCR.
Letteratura Osteopatica
La letteratura osteopatica inerente al trattamento del glaucoma sicuramente non è di grande qualità, ma può essere utile riportare un sunto per dare degli spunti per futuri lavori di ricerca. Cipolla et al. (1975) ha eseguito uno studio preliminare sugli effetti della terapia manipolativa osteopatica sulla pressione intraoculare. Il gruppo di studio era composto da 20 uomini e donne di età compresa tra i 20 ei 30 anni. Dieci soggetti sono stati usati per i controlli e 10 per il gruppo sperimentale. La terapia manipolativa osteopatica consisteva di tecniche miofasciali nelle aree cervicale e toracica superiore e veniva somministrata da un osteopata per 3-5 minuti. La pressione intraoculare è stata misurata, nel gruppo di studio trattato, immediatamente precedente al trattamento, immediatamente successivo e 4 ore dopo la terapia manipolativa osteopatica. Il gruppo sperimentale ha mostrato una diminuzione significativa della pressione intraoculare non osservata nel gruppo di controllo. Molto probabilmente questa diminuzione è avvenuta per mezzo di un'influenza di il sistema nervoso autonomo (Cipolla et al., 1975). Il design dello studio di Cipolla sembra essere molto utile. Tuttavia, si è concentrato solo su un metodo di trattamento che non è in linea con il concetto osteopatico, ma questo serve a ridurre la complessità. Inoltre si potrebbe osservare che un'ulteriore misurazione, una o due settimane dopo il trattamento, sarebbe stata utile per indagare se la riduzione della PIO mostrava un effetto a lungo termine. Misischia (1981) ha valutato la tensione intraoculare in seguito a manipolazione osteopatica nel 1981. La tensione intraoculare dei soggetti sperimentali è stata registrata prima, immediatamente dopo e 60 minuti dopo l'applicazione delle tecniche di rilascio miofasciale alle vertebre cervicali e dorsali superiori per un periodo di 10 minuti. I risultati preliminari hanno dimostrato un innalzamento medio della tensione di 2-4 mmHg immediatamente dopo la manipolazione, seguito da una diminuzione media di 3-5 mmHg al di sotto delle registrazioni di tensione iniziale 60 minuti dopo il trattamento manipolativo. Si propone che questa diminuzione della tensione sia il risultato diretto dell'influenza sul controllo autonomo del deflusso dell'umore acqueo (Misischia, PJ, 1981). Nel 1982 Feely ipotizzò che il trattamento manipolativo osteopatico dei muscoli paravertebrali e della miofascia delle regioni cervicale e toracica superiore potesse modificare la pressione intraoculare (PIO). Sono stati valutati 10 soggetti, cinque con diagnosi di glaucoma cronico ad angolo aperto e cinque di controllo non glaucomatosi. I soggetti sono stati divisi in un gruppo sperimentale e cinque gruppi di controllo. Il gruppo sperimentale comprendeva soggetti sottoposti al trattamento manipolativo nella regione cervicale e toracica superiore per glaucoma. Il gruppo di controllo 1 soggetti affetti da glaucoma a cui non era stato somministrato un trattamento manipolativo. I soggetti di controllo del glaucoma del gruppo 2 hanno ricevuto un trattamento manipolativo nelle regioni inferiori del torace e della regione lombare. Il gruppo di controllo 3 di soggetti non glaucomatosi ha ricevuto un trattamento manipolativo come il gruppo sperimentale. Il gruppo di controllo 4 comprendeva soggetti normali senza alcuna manipolazione trattamento. Il gruppo di controllo 5 dei soggetti normali ha ricevuto un trattamento simile al gruppo 2. Le misurazioni sono state fatte prima e dopo le procedure manipolative ad intervalli di 5, 10, 20, 30 e 60 minuti. La PIO è aumentata di 3 - 7 mmHg a 5 minuti dopo il trattamento nella maggior parte dei gruppi di glaucoma, seguita da una variata risposta alla pressione durante il corso dei 60 minuti (Feely et al., 1982). In questo studio il piccolo gruppo di pazienti è suddiviso in troppi sottogruppi. Inoltre, ancora una volta il trattamento è ridotto a un solo metodo. Fowler et al. (1984) hanno analizzato il ruolo del sistema nervoso simpatico nell'ipertensione oculare. Lo scopo di questo studio era di indagare l'effetto del trattamento manipolativo osteopatico (OMT) della regione cervicale inferiore, toracica superiore (C8-T2) sul controllo simpatico dell'occhio e, quindi, sulla PIO. In questo studio hanno partecipato 10 soggetti a cui era stata diagnosticata una ipertensione oculare senza le caratteristiche tipiche del glaucoma. Non erano in terapia e solo i soggetti con disfunzione somatica a C8-T2 sono stati inclusi nello studio. Sono stati divisi in tre gruppi. Il gruppo sperimentale è stato trattato nella regione cervico-toracica. Il gruppo di controllo 1 è stato trattato nella regione toracica inferiore e nella regione lombare superiore. Il gruppo di controllo 2 non ha ricevuto alcun trattamento. Le letture tonometriche sono state effettuate prima dell'OMT, immediatamente dopo l'OMT e ad intervalli di 5, 15 e 30 minuti dopo la procedura. C'è stato un significativo aumento della pressione intraoculare a 15 minuti dopo la manipolazione. Non vi è stato alcun cambiamento significativo nel deflusso acquoso in entrambi i soggetti trattati con tecniche dirette a C8-T2. Le conclusioni dell’Autore sono: 1) il trattamento ha interessato il sistema nervoso autonomo all'occhio; 2) una gamma più ampia di OMT, estesa alle vertebre cervicali superiori è necessaria per influenzare il sistema nervoso autonomo dell’occhio; 3) gli effetti dell'OMT possono essere più evidenti in un momento successivo ai 30 minuti. Fowler sottolinea come limiti dello studio stesso il trattato solo di un centro del sistema nervoso autonomo, riducendo il trattamento all'applicazione di un’unica tecnica e che la divisione di un gruppo così piccolo di pazienti in tre sottogruppi. Nel 2001 Hürlimann e Wanner hanno studiato gli effetti del trattamento osteopatico sulla pressione intraoculare in soggetti con valori di pressione fisiologici, reclutando 24 soggetti di età compresa tra 18 e 65. Ognuno di loro ha ricevuto due trattamenti simulati (sham) e due osteopatici; la misurazione della pressione intraoculare è stata effettuata prima e dopo i trattamenti. I soggetti sono stati divisi in tre gruppi e ogni gruppo è stato trattato con una solo metodo di trattamento osteopatico (CV4, pompa del vomero, induzione sacro). Le misurazioni non hanno mostrato alcuna differenza essenziale tra il trattamento simulato e quello osteopatico. Entrambi i metodi di trattamento hanno raggiunto una riduzione della pressione di 2 mmHg, che equivale ad una normale riduzione dello stato di rilassamento. Da un punto di vista osteopatico è discutibile se si può ridurre un problema così complesso all'applicazione di una singola tecnica. In secondo luogo, la divisione di un piccolo gruppo di soggetti in tre sottogruppi non sembra vantaggiosa. Un'ulteriore limite in questo studio è che i soggetti reclutati avevano valori fisiologici di PIO, è difficile ridurre valori che rientrano in un range fisiologico. Esser ha trattato 25 pazienti con glaucoma cronico primario aperto e pressioni intraoculari fino a 30 mmHg con sette metodi osteopatici predefiniti in tre sedute (la seconda dopo 1 settimana e la terza dopo 3 settimane). La misurazione della pressione intraoculare è stata eseguita dallo stesso Esser prima e dopo il trattamento. Nel periodo della terapia la pressione intraoculare si era ridotta circa 1-2 mmHg (Esser, 2002). Esser ha svolto sicuramente un buono studio, tuttavia, presenta 3 limiti: lo stesso operatore che valuta la PIO ed esegue il trattamento; i pazienti sono stati trattati solo applicando metodi osteopatici pre-progettati; è difficile interpretare i risultati senza un gruppo di controllo, perché anche un trattamento cieco come descritto da Hürlimann e Wanner può indurre riduzione della PIO. Una più recente ricerca (Bilgeri 2006) per indagare su questo argomento ha utilizzato 20 pazienti, che hanno dovuto rispettare dei criteri di inclusione o esclusione definiti. Il campione è stato suddiviso in un gruppo sperimentale (10 pazienti) e un gruppo di controllo (10 pazienti). In tutti i pazienti il parametro primario, la pressione intraoculare, è stato misurato e registrato nella prima e nella quinta settimana mediante tonometria di Goldmann da parte di un oculista. È stato utilizzato un questionario per chiedere al gruppo sperimentale i parametri secondari come mal di testa, dolore oculare, dolore al collo o altri sintomi, prestazioni visive e l'uso di farmaci inclusi i loro effetti collaterali. I pazienti del gruppo sperimentale sono stati sottoposti ad un esame osteopatico con relativo trattamento (vedi tabella 1), abbinato alla attuale condizione, nella seconda, terza e quarta settimana. Nel gruppo di controllo è stata misurata solo la pressione intraoculare. Il presente studio rivela che i risultati del trattamento rispetto al parametro primario erano leggermente migliori nel gruppo sperimentale rispetto al gruppo di controllo. Per quanto riguarda i parametri secondari nel gruppo sperimentale il trattamento osteopatico è stato molto efficace. Il più recente articolo inerente il trattamento del glaucoma mediante tecniche MET e miofasciali è di Pandey (2017). L’Autore ha trattato in 12 soggetti affetti da glaucoma, riscontrando un miglioramento medio significativo della PIO di circa 3.1± 1.9 mmHg (p< 0.001) dopo applicazione di tecniche miotensive e fasciali per 30 minuti per 6 giorni per 3 settimane.
Trattamento osteopatico
Visto che la PIO si può alzare a causa di una disfunzione autonomica del bulbo oculare, ossea e/o muscolare il trattamento osteopatico deve essere indirizzato alle possibili cause.
Disfunzione autonomica dell’occhio
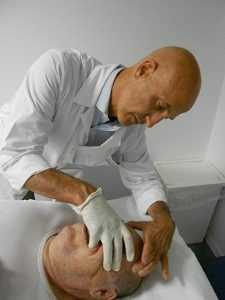
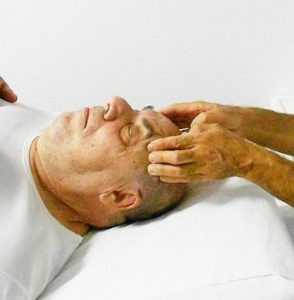
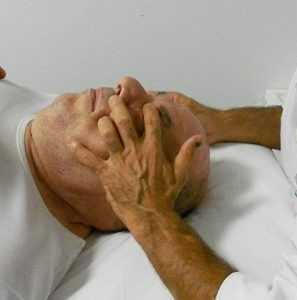 fig. 11a - tecnica di Ruddy per incrementare il riassorbimento dell'umore acqueo. Posizione del dito sulla palpebra
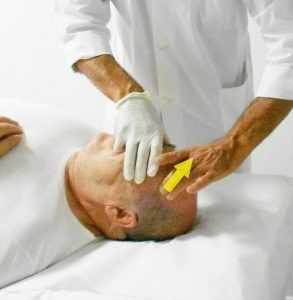
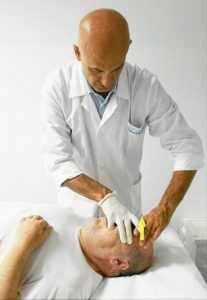
fig. 11a - tecnica di Ruddy per incrementare il riassorbimento dell'umore acqueo. Posizione del dito sulla palpebraNella letteratura osteopatica sono descritti diverse tecniche per il miglioramento della circolazione all'interno dell'occhio con associato drenaggio dell'umore acqueo attraverso il sistema dei seni intracranici. Le prime indicazioni del trattamento osteopatico in oftalmologia, sono del dott. Littlejohn sull’American Journal of Optometry del 1938 (cliccare per il PDF) e del 1956 nella raccolta del Year Book di Maidstone (Wernham 1996) (cliccare per il PDF). Per la gestione della PIO attraverso l’incremento del riassorbimento a livello del trabecolato sclerocorneale sono state proposte delle tecniche osteopatiche da Ruddy (1962) (cliccare per il PDF). L’Autore propone il trattamento osteopatico indirizzato a diverse strutture dell’occhio: globo oculare, muscoli estrinseci, muscoli palpebrali. L’Autore, per questi trattamenti, suggerisce di utilizzare un particolare strumento chiamato “eye finger” appoggiato sulle palpebre, in mancanza di questo strumento utilizzare le falangi dell’indice di una mano appoggiato in senso latero mediale (apice del dito verso il naso) sulla palpebra superiore (fig. 11a) per indurre delle spinte alternate o delle percussioni al fine di realizzare un drenaggio linfatico (lymphatic pump ).
Dalla posizione equatoriale di partenza l’indice deve essere direzionato lungo assi diversi per indurre un drenaggio omogeno lungo tutta la circonferenza del passaggio sclero corneale. Per gestire meglio le pressioni è stato consigliato indurre la spinta o la percussione con i polpastrelli dell’indice-medio dell’altra mano (fig. 11b). Per ridurre il fastidio/dolore che tale manovra può indurre, l’Autore consiglia, prima di iniziare, di utilizzare qualche goccia di anestetico locale.
Disfunzione cranica
Per favorire lo scarico dell’umore acqueo è stato proposto, già da Sutherland nel 1988, il trattamento cranico dei forami di percorrenza del sistema venoso di scarico e dei seni della dura.
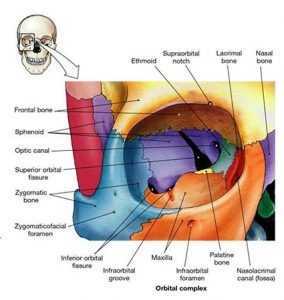
La tecnica Cant Hook può essere utilizzata per rilasciare la fessura orbitale superiore nell’ottica di migliorare il flusso della vena oftalmica superiore (Kuhmann 2007). Questa tecnica opera mediante leva e può essere applicata a varie suture craniche. Poiché i confini superiori delle fessure orbitali sono costituiti dalle ossa sfenoide e frontale, rilasciando la sutura sfeno frontale (fig. 12) è possibile aprire il forame, migliorando così il flusso delle vene oftalmiche che lo attraversa.
Con il paziente disteso in posizione supina l’osteopata si posiziona seduto alla testa del lettino di trattamento, dal lato opposto della disfunzione. L’osteopata posiziona la mano caudale intra oralmente, posizionando il V dito sul processo pterigoideo laterale, il II, III e IV dito sono posizionati esternamente la bocca, cercando un contatto sulla grande ala dello sfenoide del lato della disfunzione (fig. 13a).
Se la mano è abbastanza grande, relativamente al viso del paziente, posizionare il pollice esternamente sull'ala controlaterale dello sfenoide (fig. 13b). La mano caudale così posizionata stabilizza lo sfenoide in posizione.
La mano cefalica, invece, si estende con il pollice e l'indice sull'osso frontale superiormente ai processi zigomatici (fig. 13 b).
Mentre lo sfenoide è tenuto saldamente in posizione, la mano cefalica traziona l'osso frontale in direzione supero-anteriore (fig. 13c) e mantiene questa posizione fino a quando non si avverte uno svolgimento dei tessuti. Questo atto, disimpegna l'osso frontale dalla grande ala dello sfenoide.
Per disimpegnare l'osso frontale dalla piccola ala dello sfenoide, la trazione dell'osso frontale verrà applicata in una direzione puramente anteriore (fig.13d) e trattenuta fino a quando non si avverte un rilascio dei tessuti.
Per un disimpegno globale delle restrizioni suturali dell’osso frontale, che costituisce la maggior parte del tetto dell’orbita, dalle altre componenti ossee craniche circostanti, è stato proposto in letteratura (Bach 2017) la tecnica del frontal lift.
L’osteopata seduto alla testa del lettino, con il paziente in posizione supina, contatta leggermente gli aspetti laterali dell'osso frontale con i polpastrelli del III e IV dito e applica una trazione in direzione anteriore (verso il soffitto) (fig. 14a). Bisogna usare solo una pressione sufficiente per evitare di scivolare sulla pelle e la trazione non dovrebbe raggrinzire in modo significativo la pelle della fronte. La trazione viene continuata fino a sentire il rilascio miofasciale.
Nella figura 14b viene riportata una presa alternativa con l’eminenza tenare ed ipotenar, per eseguire la tecnica del frontal lift.
Disfunzione seni venosi
E’ buona norma iniziare a liberare da valle lo scarico venoso, con delle tecniche sull’orifizio toracico superiore, fino ad arrivare alle vene oftalmiche.
Per migliora il drenaggio venoso della regione peri orbitale, che può comprimere sul nervo ottico, Bach (2017) propone 4 tecniche:
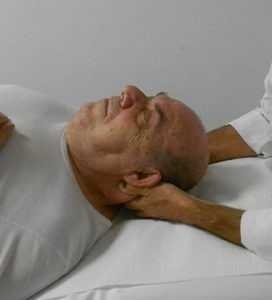
1) l’osteopata, seduto a capo del lettino con paziente supino, posiziona le mani sulla testa del paziente con i polpastrelli delle dita di entrambe le mani parallele l'una all'altra sull'occipite, nella regione della confluenza dei seni e la presa viene mantenuta fino a quando non si presenta un rilascio dei tessuti (fig. 15a);
2) successivamente, i polpastrelli delle dita vengono spostati lungo la regione dell'occipite corrispondente al seno retto su entrambi i lati del cranio e mantenute fino a quando non si percepisce il rilascio (fig. 15b);
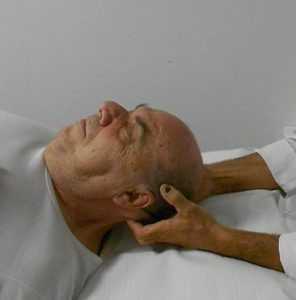
3) a partire dalla porzione più posteriore del seno sagittale superiore, l’osteopata incrocia i pollici su entrambi i lati del seno e separa la fascia cranica allontanando i pollici l'uno dall'altro (fig. 15c). Questa posizione viene mantenuta fino a quando non viene avvertito un rilascio. Tale azione viene continuata spostando le dita anteriormente lungo il seno sagittale superiore (fig. 15d), ripetendo la stessa tecnica fino a quando non raggiunge la sutura coronale;
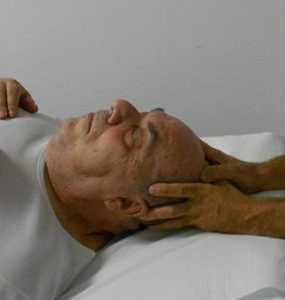
4) l’osteopata posiziona entrambe le serie di polpastrelli paralleli su entrambi i lati della sutura metopica e induce una trazione alle strutture fasciali fino a quando non si avverte un rilascio (fig. 15e). Così facendo la tecnica è completa e dovrebbe migliorare il drenaggio dei seni venosi del cranio.
Disfunzione muscolare
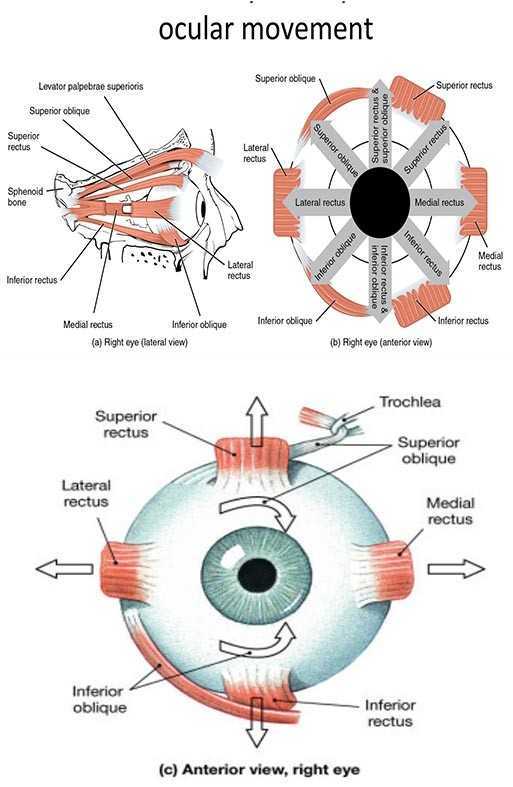
Per il trattamento dei muscoli estrinseci, proposto da Ruddy (1962) in modo specifico per le problematiche dell’eteroforie, può risultare utile anche nel glaucoma vista la relazione dimostrata tra questi muscoli e la PIO. I muscoli extraoculari, infatti, partecipano alla regolazione della tensione del bulbo e della cornea (Duke-Elder and Duke-Elder;1931; Duke-Elder and Duke-Elder; 1933; Raczynski et al. 1985; Morrison e Pollack 2003); anche un’intensa contrazione del muscolo orbicolare può aumentare la PIO oltre i 50 mm Hg (Miller 1967). Uno squilibrio nel tono dei muscoli oculari (fig. 16), inoltre, può causare una disfunzione del movimento a livello dell'osso sfenoide, del mascellare e dei nervi dei muscoli oculari stessi.
Per il glaucoma è consigliato l’applicazione di una serie di tecniche di energia muscolare progettate per bilanciare il tono muscolare extra-oculare (Pandey 2017).
Queste tecniche utilizzano i tradizionali principi di energia muscolare con l’osteopata che applica la resistenza contro il globo oculare per aumentare la resistenza ai muscoli mentre il paziente tenta di guardare in una direzione specifica. Ruddy (1962) suggerisce di richiedere una contrazione del paziente ritmica e non costante, come le più conosciute tecniche di Mitchell (1998), ad un ritmo più o meno simile al ritmo cardiaco del paziente.
Dopo circa 10 contrazioni (movimenti oculari contro la resistenza dell’osteopata) si richiede un rilassamento dove si ricerca il massimo movimento del globo. L’asse di azione della contro spinta da parte del dito dell’operatore deve essere in asse ma con direzione apposta con la linea di azione del muscolo da trattare (fig. 17a, 17b). Questa operazione viene effettuata nelle direzione di tutti i muscoli extra oculari.
Bilanciamento della tensione legamentosa dell’orbita (BLT)
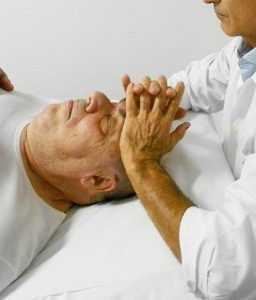
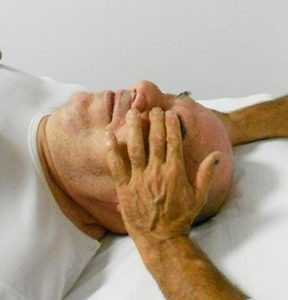 fig. 18a - posizione delle dita per la BLT delle fasce dell'occhio
fig. 18a - posizione delle dita per la BLT delle fasce dell'occhio 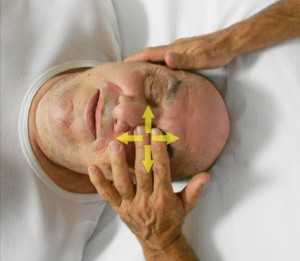 fig. 18b - ricerca dell'equilibrio nei diversi piani dello spazio
fig. 18b - ricerca dell'equilibrio nei diversi piani dello spazioPromuove il drenaggio della vena oftalmica per il glaucoma ad angolo aperto cronico e il glaucoma acuto ad angolo chiuso e l'edema peri-orbitale da Mixedema, da esoftalmo per malattia di Basedow- Graves e altri disturbi legati alla tiroide. L’osteopata si posiziona seduto alla testa del lettino da trattamento con il paziente disteso supino.
L’osteopata contatta l'occhio del paziente, che ha le palpebre chiuse, con i polpastrelli del II e III dito (fig. 18). Valuto l'equilibrio o il punto medio del movimento quando sposta la fascia sopra la palpebra/occhio in tutte le direzioni (medio /laterale, superiore/inferiore e in senso orario/antiorario), le posizioni specifiche sono impilate e trattenute (fig. 18b) fino a quando non viene avvertito un rilascio (Bach 2017).
Avvenuto il rilascio si rivaluta la tensione fasciale nelle suddette direzioni. Questa tecnica può aiutare a detendere le connessioni fasciali tese nella muscolatura extraoculare e favorire il drenaggio venoso delle vene oftalmiche.
Stili di vita
E’ sconsigliabile fare grandi sforzi fisici e, soprattutto, vanno evitate le posizioni a testa in giù durante determinate pratiche sportive (nello yoga, nella ginnastica artistica, da evitare il bumping jumping, ecc.). Naturalmente l’aumento della pressione intraoculare è solo transitoria in questi casi, dunque si possono correre eventuali rischi soprattutto se la pressione è borderline. Invece, fare regolarmente uno sport in modo moderato pare contribuisca alla prevenzione del glaucoma (Natsis 2009; Roddy and Ellemberg 2012). Sebbene non sia scientificamente dimostrata in modo stringente una forte correlazione, per prudenza l’assunzione di caffè dovrebbe essere limitata a poche tazzine al giorno.
Ringraziamenti
Grazie agli amici Paolo Glessi (DO, DOmROI) e Pietro Gheller (Optometrista, Psicologo, docente OSCE) per il prezioso aiuto dato alla ricerca del materiale bibliografico messo a disposizione in questo articolo.
Bibliografia
Bach A. Osteopathic Manipulative Treatment of the Eye. Available from: https://www.researchgate.net/publication/317007759_Osteopathic_Manipulative_Treatment_of_the_Eye. May 18, 2017
Bilgeri S. The Impact of Osteopathic Treatment on Increased Intraocular Pressure in Primary Chronic Open-Angle Glaucoma [dissertation]. Vienna, Austria: Danube University; 2006
Bilgeri S. The Impact of Osteopathic Treatment on Increased Intraocular Pressure in Primary Chronic Open-Angle Glaucoma [dissertation]. Vienna, Austria: Danube University; 2006.
Chiu C, Miller MC, Caralopoulos IN, et al. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 2012;9:3
Cipolla VT, Dubrow CM, Schuller EAJr. Preliminary study: an evaluation of the effects of osteopathic manipulative therapy on intraocular pressure. J Am Osteopath Assoc. 1975;74(5):433-437
Congdon N, Wang F, Tielsch JM. Issues in the epidemiology and population-based screening of primary angle closure glaucoma. Surv Ophthalmol 1992; 36:411–23.
Davison H. Physiology of the cerebrospinal fluid. London: J & A Churchil Ltd; 1967. Duke-Edler WS, Duke- Edler PM. The clinical significance of the ocular musculature. Br J Ophthalmol 1932;321-35.
Duke-Elder PM, Duke-Elder, W.S. Studies on the Intraocular Pressure, The Action of Drugs on the Vascular and Muscular Factors Controlling the Intraocular Pressure. J. Physiol. 1931; 71, 1-30.
Esser T. (2002): Kann durch osteopathische Techniken eine Senkung des Augeninnedrucks beim primärchronischen Offenwinkelglaukom bewirkt werden – eine Pilotstudie. www.osteopathie1.de/publikationen.html, 6 November 2005
Feely RA, Castillo TA, Greiner JV. Osteopathic manipulative treatment and intraocular pressure. J Am Osteopath Assoc. 1982;82(9):60.
Fowler et al. (1984): The role of the sympathetic nervous system in ocular hypertension. In: JAOA, 84(1):72.
Frezzotti P, Giorgio A, Toto F, De Leucio A, De Stefano N. Early changes of brain connectivity in primary open angle glaucoma. Hum Brain Mapp. 2016 Dec;37(12):4581-4596.
Giorgio A, Zhang J, Costantino F, De Stefano N, Frezzotti P. Diffuse brain damage in normal tension glaucoma. Hum Brain Mapp. 2018 Jan;39(1):532-541.
Hardy J and Selkoe DJ. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics. Science. 2002;297:353–6.
Hürlimann S., Wanner, C.(2000-2002): Auswirkung einer osteopathischen Behandlung auf den Augendruck. www.osteopathie- basel.ch/studien.html, 6 November 2005
Jacob A, Thomas R, Koshi SP, Braganza A, Muliyil J. Prevalence of primary glaucoma in an urban south Indian population. Indian J Ophthalmol 1998; 46:81–6.
Jonas JB, Wang N, Yang D. Translamina cribrosa pressure difference as potential element in the pathogenesis of glaucomatous optic neuropathy. Asia-Pac J Ophthalmol. 2016;5:5–10.
Killer HE, Pircher A. Normal tension glaucoma: review of current understanding and mechanisms of the pathogenesis. Eye (Lond). 2018 May;32(5):924-930.
Kuhmann O. The Impactof Osteopathic Treatment on Intraocular Hypertension—An Experimental Study [disertation]. Gochsheim, Germany: Danube University; 2007
Lai SW, Lin CL, Liao KF. Glaucoma may be a non-memory manifestation of Alzheimer’s disease in older people. Int Psychogeriatr. 2017:1–7.
Lim ASM. Primary angle-closure glaucoma in Singapore. Aust J Ophthalmol 1979;7:23–30.
Linden C, Qvarlander S, Johannesson G, et al. Normal-tension glaucoma has normal intracranial pressure: a prospective study of intracranial pressure and intraocular pressure in different body positions. Ophthalmology. 2017;1–8.
Littlejohn JM. 1956 in Wernham J. Classical Osteopathy. College of Classical Wernham Osteopathy. 1996 pp. 296-308 (cliccare per il PDF)
Little John. Optometry and Vision Science: April 1938 – Volume 15 – Issue 4 – pag 151- 158 ) (cliccare per il PDF)
Miller D. Pressure of the lid on the eye. Arch Ophthalmol 1967; 78: 328–30
Misischia PJ. The evaluation of intraocular tension following osteopathic manipulation. J Am Osteopath Assoc. 1981;80:750.
Mitchell F Jr. The Muscles Energy Manual. MET Press, East Lansing Michigan 1998
Morgan WH, Yu DY, Cooper RL, Alder VA, Cringle SJ, Con- stable IJ. The influence of cerebrospinal fluid pressure on the lamina cribrosa tissue pressure gradient. Invest Ophthalmol Vis Sci. 1995;36:1163–72.
Morrison JC, Pollack IP. Glaucoma Science and Practice. New York:Thieme;2003:150-1.
Natsis K. Aerobic exercise and intraocular pressure in normotensive and glaucoma patients; BMC Ophthalmol 2009;9:1-7.
Pandey R. Effect of MET & MFR on Primary open Angle Glaucoma in adul aged between 15-30 years. International Journal of Advance Research and Development 2017; 2:1, 14-17 https://www.ijarnd.com/manuscripts/v2i1/V2I1-1138.pdf
Pircher A, Remonda L, Weinreb RN, Killer HE. Translaminar pressure in Caucasian normal tension glaucoma patients. Acta Ophthalmol (Copenh). 2017;95:e524–31.
Quigley HA, Hohman RM, Addicks EM, Massof RW, Green WR. Morphologic changes in the lamina cribrosa correlated with neural loss in open-angle glaucoma. Am J Ophthalmol. 1983;95:673–91.
Quigley HA. Number of people with glaucoma worldwide. Br J Ophthalmol. 1996;80:389-93.
Raczynski JM, Mason DA, Wilson RP, Silvia ES, Kleinstein RN. Muscular and intraocular pressure responses among ocular-hypertensive subjects: is there a rationale for biofeedback? Biofeedback Self Regul. 1985 Dec;10(4):275-88.
Roddy G. and Ellemberg D. Prevention of Glaucoma through Exercise: A meta-analysis J Vis 2012;12:483
Rojas B, Ramirej AI, Salzar JJ Ramirez JM, Trivino A. Structural changes of the anterior chamber angle in primary congenital glaucoma with respect to normal development. Arch Soc Esp oftalmol 2006;81:65-72.
Ruddy TJ. Osteopathic manipulation in eye, ear, nose, and throat disease. In: Barnes MW, ed. 1962 Year Book of Selected Osteopathic Papers. Carmel, Calif: Academy of Applied Osteopathy; 1962:133-140 (cliccare per il PDF)
Serot JM, Zmudka J, Jouanny P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. J Alzheimer’s Dis: JAD. 2012;30:17–26
Stowell C, Burgoyne CF, Tamm ER, Ethier CR. Biomechanical aspects of axonal damage in glaucoma: A brief review. Exp Eye Res. 2017;157:13–9.
Sutherland, WG (1997): Contributions of Thought. The collected Writings of William Garner Sutherland. p. 171
Tarasoff-Conway JM, Carare RO, Osorio RS, et al. Clearance systems in the brain-implications for Alzheimer disease. Nat Rev Neurol. 2015;11:457–70.
Tham YC, Li X, Wong TY, Quigley HA, Aung T, Cheng CY. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis Ophthalmology. 2014 Nov;121(11):2081-90.
Tsolaki F, Gogaki E, Tiganita S, et al. Alzheimer’s disease and primary open-angle glaucoma: is there a connection? Clin Ophthalmol. 2011;5:887–90. Yablonski M, Ritch R, Pokorny KS. Effect of decreased intracranial pressure on optic disc. Invest Ophthalmol Vis Sci. 1979;18:165.